HANTAVIRUS
INFEZIONI DA HANTAVIRUS
Dott. Luciano Schiazza
Specialista in Dermatologia e Venereologia
Specialista in Leprologia e Dermatologia Tropicale
c/o InMedica - Centro Medico Polispecialistico
Largo XII Ottobre 62
16121 Genova
cell 335.655.97.70 - studio 010 5701818
www.lucianoschiazza.it
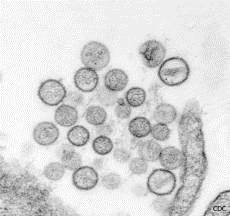
Gli Hantavirus sono virus RNA a tre segmenti con particelle sferiche-ovoidali con dimensioni di circa 100 nm di diametro, appartenenti alla famiglia delle Bunyaviridae. Se ne conoscono più di 30 sottotipi di specie virali antigenicamente diversi e distinguibili, 20 delle quali in grado di trasmettere malattie all’uomo. Diversamente da molti membri della famiglia Bunyaviridae che hanno come ospiti zanzare, zecche o mosche, ogni hantavirus è associato specificatamente ad una singola specie di roditore. Il serbatoio animale caratterizza le infezioni da Hantavirus come tipiche zoonosi.
Le hantaniosi sono un gruppo eterogeneo di malattie ad esordio acuto, che generano quadri clinici a prevalente interessamento renale o polmonare.

La prima malattia causata da hantavirus a colpire l’uomo fu riscontrata nei primi anni ’50 durante la guerra di Corea, denominata come “febbre emorragica coreana”. Migliaia di soldati delle Nazioni Unite svilupparono una misteriosa malattia caratterizzata da febbre, cefalea, emorragia e insufficenza renale acuta. Nonostante l’impegno scientifico per scoprirne la causa, solo nel 1976 fu isolato da un roditore l’agente causale, un nuovo virus, denominato virus Hantaan, dalla zona adiacente al piccolo fiume Hantaan che scorre in prossimità del confine tra la Corea del Nord e la Corea del Sud.
Le infezioni provocate da virus appartenenti al genere Hantavirus hanno una diffusione vastissima; sono stati riscontrati in Estremo Oriente, nella regione dei Balcani, nella penisola scandinava, in Russia. I casi riscontrati nel 1993 negli U.S.A. sono stati la prima documentazione della presenza di Hantavirus nel continente americano cui sono seguite, nel tempo, altre segnalazioni di infezioni da Hantavirus con prevalente interesse respiratorio nell'intero continente Americano.
Nelle aree endemiche non sono rare le forme miti e le infezioni inapparenti. Due sono le forme proprie dell’infezione da hantavirus:
-
una forma caratterizzata da sintomi simil-influenzali (febbre, cefalea, dolori addominali e lombari, congestione del volto), petecchie, emorragie multiple (emottisi, ematuria, ematemesi) e interessamento renale, comunemente identificata come febbre emorragica con sindrome renale (HFRS).
-
una forma propria degli Stati Uniti e di altre zone del continente americano, con alto tasso di mortalità (40-50% dei casi), con sintomi prevalenti a carico dell’apparato respiratorio (con insufficienza respiratoria acuta), la sindrome polmonare da hantavirus (ARDS, HPS).
La fonte di infezione è rappresentata ovunque dai roditori domestici, sinantropi o selvatici mentre l’uomo rappresenta solo un ospite accidentale: il virus è presente nella loro saliva, urine e deiezioni. La trasmissione avviene per via aerea, ossia quando si effettuano manovre che generano particelle di aerosol/polvere in ambienti contaminati, dove sia stata accertata la presenza dell’animale infetto.
Le hantaniosi sono delle zoonosi in quanto serbatoio e sorgente dell’infezione sono i roditori (ratti, topi e scoiattoli) selvatici, sinantropi o domestici (zoonosi: qualsiasi malattia e/o infezione che possa essere trasmessa naturalmente, direttamente o indirettamente, tra gli animali e l'uomomalattia che si trasmetta dall’animale all’uomo). Ogni hantavirus ha uno specifico roditore ospite il quale non manifesta segni di malattia: è asintomatico.
I roditori diffondono il virus nell’ambiente attraverso i loro secreti (urine, feci, saliva), per tutta la loro vita. Tuttavia vi è un periodo di maggiore emissione virale nelle 3-8 settimane che seguono l’infezione iniziale. Animali predatori come cani, gatti e coyotes possono infettarsi ma è poco probabile che siano in grado di trasmettere l’infezione ad altri animali o all’uomo. Sono in grado però di portare roditori infetti a contatto con l’uomo.
Ad ogni sierotipo corrisponde un roditore.
In Asia gli hantavirus sono principalmente associati a roditori della famiglia dei Muridi (Muridae) e in Europa con la sottofamiglia Arvicolinae.

Tra gli hantavirus Eurasiatici l’ospite principale per il virus Hantan è il topo selvatico a dorso striato (Apodemus agrarius) che vive in zone boscose ma può spingendosi anche nelle aree antropizzate, con abitudini prevalentemente crepuscolari o notturne.
In Italia tende a colonizzare le aree rurali non eccessivamente coltivate e ricche di siepi ed aree di sottobosco.

In Asia e nell’Europa dell’Est è invece l’Apodemus flavicolis a trasmettere il Dubrova virus, responsabile di gravi forme di HFRS.

Soprattutto in Asia è presente il sierotipo Soeul responsabile di una infezione meno grave, con un tasso di mortalità inferiore all’1%, il cui ospite specifico è il ratto Rattus norvegicus.

In Scandinavia e nell’Europa dell’Est vi è un altro virus responsabile di una forma lieve di HFRS, il virus Puumala, il cui ospite primario è il Clethrionomys glareolus.
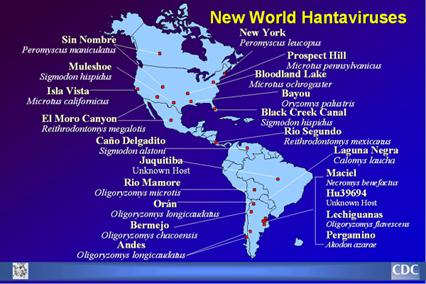
Nella immagine accanto proposto dal CDC si notano i legami tra i vari sieropti virali ed i roditori specifici.
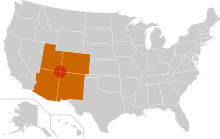
Nel Nord America il Sin Nombre virus (dallo spagnolo “virus senza nome”) rappresenta il responsabile di moltissimi casi.
Inizialmente era chiamato “Four corners virus”, dalla regione degli Stati Uniti nella quale si incontrano l’angolo sud-ovest del Colorado, l’angolo nord-ovest del New Mexico, l’angolo nord-est dell’Arizona e l’angolo sud-est dello Utah., nella quale si evidenziò una epidemia virale (navajo flu) nella popolazione Navajo, principali abitanti di quest’area (Navajo Nation) .
Nel Sud America invece è il sierotipo Andes la causa di molti casi in Cile e in Argentina. Le differenze filogenetiche tra le specie di hantavirus sono legate direttamente alla distanza geografica tra i luoghi dove i virus sono stati identificati.
Gli hantavirus che causano la HPS sono associati con roditori della famiglia dei Muridi, sottofamiglia delle Sigmodontine(Sigmodontinae).
Questa sottofamiglia comprende circa 430 specie, comprese i roditori selvatici che sono differenti da quelli conosciuti come urbani. Questi roditori, come il ratto domestico, il ratto comune o ratto nero (rattus rattus), il ratto norvegese (rattus norvegicus noto anche come ratto marrone, ratto grigio, ratto delle chiaviche o pantegana, della sottofamiglia dei Murini-Murinae, di origine asiatica), hanno origine nel Vecchio Continente. Il ratto norvegese ha soppiantato il ratto nero in Europa.
Il principale ospite del virus Sin Nombre è il il Peromyscus maniculatus, nativo del Nord America, presente nelle aree rurali di quasi tutto il Nord America, soprattutto nelle aree ad ovest del Mississippi. Oltre al Sin nombre virus, altri hantavirus possono causare la HPS, quali il New York virus associato col Peromyscus leucopus, il Black Creek Canal virus il cui ospite è il Sigmodon hispidus, e il Bayou virus, veicolato dall’Oryzomys palustris.
-
Nel Sud America molte specie di hantavirus sono associate alla HPS: Juquitiba, Castelo dos Sonhos e Araraquara (Brasile);
-
Laguna Negra (Bolivia e Paraguay);
-
Oran, Lechiguanas e Marmejos (Argentina del nord e del centro);
-
andes virus (cile e Argentina)
In Brasile ospiti dei virus sono Hesperomyinae Akodon, l’Oligoryzomys microtis, il Balomys lasiurus. L’uomo rappresenta un ospite accidentale e può infettarsi attraverso il contatto con l’urina, la saliva o le feci dei roditori oppure attraverso l’inalazione di polvere contaminata con gli escreti dei roditori (aerosol contenenti particelle di escreti freschi o essiccati e successivamente dispersi nell’ambiente) e occasionalmente attraverso il morso del roditore.
La trasmissione interumana, attraverso il contatto con sangue od escreti, nelle forme emorragiche con sindrome renale è una eventualità eccezionale se vengono rispettate le norme di precauzione.
TRASMISSIONE VIRALE
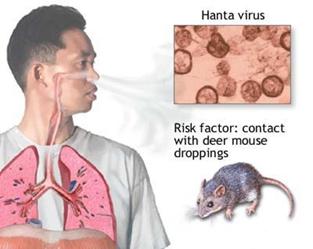
Abbiamo già accennato come i roditori infettati, sia selvatici sia domestici, diffondano il virus nell'ambiente tramite i loro escreti (feci, urine, saliva), per tutta la loro vita. Ciò avviene allorché particelle di escreti freschi o essiccati si diffondono nell'aria; l'uomo, inalando accidentalmente questo aerosol infetto, contrae il virus.
Altri potenziali meccanismi, benché rari, sono il contatto diretto col roditore infetto o il suo morso, il consumo di acqua o cibo contaminati dal virus.
La trasmissione interumana non viene contemplata tra le modalità infettive ad eccezione:
-
del contatto con il sangue od i secreti di persona affetta da HFRS.
-
dell’infezione col virus Andes.
Riguardo al primo punto, è una eventualità eccezionale se vengono seguite le normali regole precauzionali. Per quanto riguarda il sottotipo Andes virus (chiamato anche Orano, Castelo de Sonhos, Lechiguanas, Juquitiba, Araquara e Bermelo virus), durante un’epidemia di infezione polmonare in Argentina nei dintorni di Bariloche, evidenze epidemiologiche avrebbero confermato la possibilità della trasmissione interumana, compresa la trasmissione a cinque medici e altri operatori sanitari. A conferma della trasmissione interpersonale il caso di due persone che non avevano soggiornato nella zona di Bariloche, ma che si infetttarono in Buenos Ayres dopo che erano stati trasferiti in ospedale. Negli USA questa eventualità non è mai stata osservata.
Riguardo alla relazione tra clima e infezione da hantavirus, l'esperienza di precedenti episodi infettivi della forma polmonare (HPS) indica che l'aumento delle precipitazioni è seguito dalla comparsa di una esplosione epidemica delle infezioni.
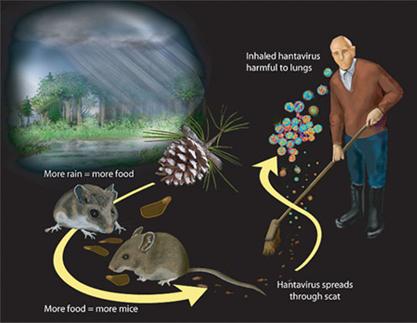
La spiegazione sarebbe da porsi in relazione all’equazione aumento significativo delle precipitazioni = abbondanza di cibo per i roditori: ciò comporta un aumento della natalità e quindi un aumento della loro popolazione. Quando successivamente segue un periodo di aridità, scarseggiando le fonti di cibo, diventa difficile per i roditori alimentarsi. Si dirigono allora verso l’ambiente abitato dall'uomo, poco competitivo, creando così le condizioni per una esplosione della malattia.
La trasmissione orizzontale (roditore-roditore) del virus è supportata dalla presenza del virus nella saliva dei roditori, soprattutto maschi. Ciò trova spiegazione nella competizione per il cibo tra individui della stessa specie quando la scarsità di cibo fa seguito a periodi di maggiore fertilità. La prevalenza nel roditore maschio si spiega con la sua maggiore competitività e aggressività.

FATTORI DI RISCHIO
Abbiamo già visto come il contatto diretto con i roditori infetti o con i loro escreti esponga al rischio di acquisire l’infezione da hantavirus.
E’ un criterio generale. Vi sono però categorie di persone che sono più a rischio, quali: contadini, boscaioli, soldati, profughi, cacciatori, campeggiatori, escursionisti (soprattutto in chi dorme a diretto contatto col terreno), muratori, addetti alla disinfestazione, ricercatori che utilizzano roditori selvatici, addetti alla pulizia di edifici o strutture che sono attivamente infestate da roditori o sono inabitate da tempo (silos, garage, silos, baracche, capannoni agricoli), turisti in aree a rischio.
CLINICA
Due sono le manifestazioni cliniche dell’infezione da hantavirus causate da differenti ceppi virali:
-
la febbre emorragica con sindrome renale (HFRS),
osservata in Europa ed in Asia
-
la sindrome polmonare da hantavirus (HPS)
osservata in America del nord e del sud
Una forma più mite, causata dal virus Soeul e trasmessa dai ratti si manifesta in Giappone, Corea, Cina, Stati Uniti ed Europa, soprattutto nei porti di mare dove i ratti sono comuni. E’ stata descritta come nefropatia epidemica (NE). Non si ritiene che si tratti di una entità autonoma ma semplicemente di una forma lieve di HFRS, con sequenza di sintomi simili alla HFRS, compresa la nefrite (infiammazione dei reni). Solo il 6% dei casi confermati sierologicamente necessitano di ospedalizzazione con una letalità dello 0.5%. FEBBRE EMORRAGICA CON SINDROME RENALE (HFRS)
All’HFRS sono riferibili alcune malattie che inizialmente venivano denominate febbre emorragica coreana, febbre emorragica epidemica, nefropatia epidemica.
Zone particolarmente colpite dalla HFRS sono la Cina, la penisola di Corea, la Russia (Hantaan, Puumala e Souel virus), l’Europa settentrionale e occidentale (Puumala e Dobrova virus).
Il virus Hantaan si trova principalmente in Asia e meno spesso in Europa. Il virus Dobrava ( Belgrado ) nei paesi della Ex-Yugoslavia, il virus Puumala in Europa ed il virus Seoul praticamente in tutto il mondo.
I virus Hantaan e Dobrova causano le forme più gravi mentre quelle causate da virus Puumala (predominante in Europa) e virus Soeul sono meno gravi con evoluzione clinica più lieve.
Si stimano in 100.000-200.000 casi/anno di HFRS, nella maggioranza in Cina. Si osservano due picchi stagionali di malattia associati alla raccolta del grano in estate e del riso nel tardo autunno. Durante questi periodi la popolazione dei roditori ospiti aumenta ed i campo sono pieni di pulviscolo contenente escrementi secchi infettati col virus.
La malattia ha un tasso di mortalità oscillante tra il 5 ed il 15% dei casi (la maggior parte delle morti si verifica durante le fasi ipotensiva ed oliguria). Gli stadi della malattia sono sei:
-
incubazione (4-40 giorni)
-
fase febbrile (3-5 giorni)
-
fase ipotensiva (da ore a giorni)
-
fase oligurica (3-7 giorni)
-
fasi di guarigione 5. fase diuretica (2-21 giorni)
-
fase di convalescenza (2-3 mesi)
INCUBAZIONE
Tale periodo ha una durata media di 2-3 settimane (con estremi di 4-40 giorni). Trascorso tale tempo compare la
FASE FEBBRILE
Dura 3-5 giorni ed è caratterizzata da sintomi simil-influenzali ad esordio improvviso quali:
-
febbre, brividi,
-
mal di testa, dolori muscolari intensi, nausea,
-
vista annebbiata, fotofobia, dolori agli occhi durante il movimento degli stessi, arrossamento del viso, della V del decolletè e del dorso,
-
petecchie (piccole macchie rosse della pelle),
-
dolori addominali e lombari,
-
sete, edema, emoconcentrazione, ipotensione posturale.
FASE IPOTENSIVA
Può durare da poche ore a giorni (3). Scompare la febbre (defervescenza) e vi è un abbassamento improvviso della pressione arteriosa (ipotensione). A questo quadro si aggiungono:
-
ipovolemia (diminuzione del volume del sangue),
-
aggravamento delle manifestazioni emorragiche (sanguinamento): petecchie, epistassi (sanguinamento dal naso), sanguinamento gastrointestinale e intracranico.
-
Aumento dei livelli di azotemia e creatininemia nel sangue, proteinuria (eccesso di proteine nelle urine).
Leucocitosi (aumento dei globuli bianche nel sangue), trombocitopenia (diminuzione del numero delle piastrine nel sangue)
La nausea ed il vomito sono comuni in questa fase.
Circa 1/3 dei pazienti muore per shock.
FASE OLIGURICA
Questo è lo stadio nel quale metà dei pazienti muoiono per insufficienza renale. Ha una durata variabile dai 3 ai 7 giorni. I segni di malattia sono:
-
significativa diminuzione della quantità di urine emesse
-
ipervolemia (alto volume del sangue) che porta ad ipertensione
-
squilibrio degli elettroliti del sangue
-
persistenza dei sintomi emorragici
-
gravi complicazioni: insufficienza cardiaca, edema polmonare, sanguinamenti cerebrali.
Chi sopravvive alla fase oligurica passa alla
FASE DIURETICA
In questa fase i pazienti evidenziano un miglioramento della funzionalità renale. Ha una durata variabile di giorni o parecchie settimane e rappresenta l’inizio della guarigione, anche se in questo periodo i pazienti possono ancora morire per complicanze polmonari e shock. Il paziente produce grosse quantità di urine (3-6 litri al giorno) e sono evidenti i segni di un ritorno alla normale funzionalità dei reni. Persiste anoressia (mancanza di appetito e stanchezza, conseguenza della disidratazione.
FASE DI CONVALESCENZA
E’ la fase finale. Possono passare settimane o mesi prima che il paziente si riprenda completamente. Si osserva un progressivo miglioramento della filtrazione glomerulare, della perfusione sanguigna dei reni, ed un ritorno alla capacità di concentrazione delle urine.
Nella diagnosi di HFRS occorre ottenere una esauriente anamnesi con particolare riguardo all’ambiente di lavoro e valutare attentamente la clinica sia nell’aspetto dell’esame obiettivo sia per quanto riguarda le indagini di laboratorio.
I problemi diagnostico-clinici della HFRS sono:
-
l’esordio, che simula una banale influenza
-
l’esordio acuto e grave della fase ipotensiva
La diagnosi di HFRS si ottiene con la dimostrazione sierologia degli anticorpi specifici tramite test di immunofluorescenza o ELISA; all’atto dell’ospedalizzazione la maggioranza dei pazienti presenta la presenza di anticorpi IgM e la dimostrazione dell’agente patogeno con la PCR.
A supporto, gli aspetti di laboratorio propri della HFRS sono
-
trombocitopenia (diminuzione della quantità di piastrine nel sangue)
-
albuminuria (alta quantità di albumina nelle urine)
-
microematuria ( microscopica quantità di sangue nelle urine)
-
azotemia elevata
-
aumento dell’ematocrito (Ht) o emoconcentrazione (è la percentuale di volume occupato dai globuli rossi, globuli bianchi e piastrine nel sangue).
-
leucocitosi(aumento dei globuli bianchi nel sangue)
Nella diagnostica differenziale occorre prendere in considerazione la leptospirosi, le rickettsiosi, le infezioni renali di altra origine. Riguardo alla terapia, riposo a letto e ospedalizzazione precoce sono fondamentali, con terapia di supporto per affrontare eventuale stato di shock ed insufficienza renale.
Nel caso di HFRS la ribavirina, da somministrarsi il più precocemente possibile nei primi giorni di malattia, ha dimostrato una qualche efficacia.
SINDROME POLMONARE DA HANTAVIRUS (HPS) (sindrome cardiopolmonare da hantavirus - HCPS)
La sindrome polmonare da hantavirus (HPS, ARDS) fu riconosciuta per la prima volta nel 1993 in una regione semiarida del sud-ovest degli Stati Uniti, negli stati dell’Arizona, Nuovo Messico, Colorado e Utah. Durante tale epidemia, a carattere acuto, caratterizzata dall’interessamento dell’apparato respiratorio, in individui giovani, in precedenti buone condizioni di salute, le vittime furono l’80% degli ammalati. Indagini sierologiche rivelarono trattarsi di un hantavirus, simile a quello che aveva causato in Eurasia la HFRS. Dopo 8 settimane dal primo caso fu appurato che l’HPS era causata da un nuovo hantavirus, differente da quello che causava la HFRS: fu nominato “Four corners, Muerto canyon, Little water o Navajo flu” facendo riferimento alla zona dell’epidemia.
In seguito alle proteste della popolazione che viveva in quelle zone, nel vedere affiancato il loro nome ad una malattia letale, si pensò di nominare il virus Sin Nombre (“senza nome”), come compromesso in un gioco di parole (virus prima non consociuto).
Poiché il collasso cardiovascolare ha un ruolo importante nell’alto tasso di mortalità della malattia, a tale sindrome fu affiancato oltre all’acronimo HPS anche HCPS, sindrome cardiopolmonare da hantavirus.
Sempre nel 1993 fu scoperto l’ospite del virus, catturato nella vicinanza delle case abitate dalle persone ammalate: si trattava di un roditore il “Peromyscus maniculatus”(deer mouse).
Prima di tale anno, le infezioni da hantavirus erano sconosciute negli Stati Uniti.
Regioni con la più alta incidenza di HPS sono la Patagonia Argentina, Cile, Brasile, Stati Uniti, Canada e Panama, dove è stata riscontrata una forma più lieve che risparmia il cuore. Si è scoperto in seguito che eziologicamente la HPS è causata da diversi ceppi virali: Sin Nombre, New-York-1, Monongahela nel Nord America, Black Creek Canal and Bayou virus nel Sud-est degli USA (veicolati dal Sigmodon hispidus e dall'Oryzomys)
-
incubazione
-
fase febbrile
-
fase cardiopolmonare
-
fase diuretica
-
convalescenza
INCUBAZIONE Ha una durata variabile tra i 4 e 30 giorni con una media di 14-17 giorni.
La comparsa dei sintomi coincide con l’esordio della
FASE FEBBRILE In questa fase prodromica, la malattia manifesta segni e sintomi comuni con molte altre infezioni virali, tali da non far sospettare invece la gravità della situazione. Dura in media 3-5 giorni ed è caratterizzata da:
-
febbre, mialgia (dolori muscolari), astenia (il paziente si sente debilitato, spossato, senza forze), sensazione generale di malessere, cefalea (mal di testa).
-
A questi possono seguire: brividi, mal di testa, vertigini, anoressia (mancanza di appetito), dolori addominali, nausea, vomito, diarrea. A livello del sangue si può osservare una diminuzione del numero delle piastrine.
I pazienti non lamentano tosse, rinorrea (naso che cola) o altri sintomi respiratori.
Terminata la fase febbrile inizia la
FASE CARDIOPOLMONARE Questa è la fase nella quale molti pazienti ricorrono al medico per la comparsa di disturbi che interessamento il sistema cardiopolmonare. La durata è breve (4-24 ore). Generalmente questa fase sopravviene al terzo giorno dell’infezione: compare una tosse secca che tende a diventare produttiva con escreato ematico con dispnea (respirazione difficoltosa con fame d’aria) inizialmente di lieve entità ma progressivamente ingravescente e tachipnea (accorciamento del respiro) da porsi in relazione alla comparsa e rapida progressione dello shock e dell'edema polmonare e dello spazio retroperitoneale. A questo quadro si aggiungono:
-
ipovolemia dovuta alla progressiva fuoriuscita di liquidi ricchi di proteine dal sangue all'interstizio polmonare ed agli alveoli
-
ipotensione (abbassamento della pressione arteriosa) ed oliguria (diminuzione della quantità di urine emesse)
-
trombocitopenia (diminuzione della quantità di piastrine nel sangue, spesso presente anche nella fase febbrile, < 150.000) (presente già nella fase prodromica e altamente discriminatoria tra pazienti affetti da HPS e pazienti con altre malattie febbrili)
-
aumento dell’ematocrito (Ht) o emoconcentrazione (è la percentuale di volume occupato dai globuli rossi, globuli bianchi e piastrine nel sangue. Ht > 50 nell'uomo, Ht>48 nella donna)
-
aumento della creatinina nel sangue (a causa della diminuita circolazione di sangue nei reni)
-
leucocitosi (aumento dei globuli bianchi nel sangue)
-
mielocitosi (left shift leukocytosis) (aumento dei neutrofili con incremento del numero delle forme immature)
-
linfociti con caratteristiche morfologiche di immunoblasti (linfociti con dimensioni superiori di 2-3 volte un normale linfocita, con abbondante citoplasma basofilo)
La morte sopravviene entro le 24 ore (tasso di mortalità è del 40% dei pazienti).dovuta all'ipossia (mancanza di ossigeno) ed al collasso cardiocircolatorio.
In coloro che sopravvivono la guarigione è rapida ma la completa restituito ad integrum (espressione latina in uso in medicina per indicare il ritorno alla normalità di organi colpiti da una malattia) può differire di mesi, anche se in alcuni paziente persiste qualche alterazione della funzionalità polmonare..
Comunque nelle persone che sopravvivono segue la
FASE DIURETICA che dura da alcuni giorni ad alcune settimane e rappresenta l’inizio della guarigione. Vi è rapida scomparsa dell’edema polmonare, la remissione della febbre e dello stato di shock. Persiste la mancanza di appetito e la stanchezza, imputabili alla disidratazione.
FASE DI CONVALESCENZA
Può durare sino a due mesi. La funzionalità polmonare può non ritornare alle condizioni pre-malattia in quanto si riscontrano esiti cronici quali diminuzione cronica del volume microalveolare e della capacità di diffusione alveolare. Nella HPS l’interessamento renale e le manifestazioni emorragiche sono evenienze molto rare, se non in casi di particolare gravità.
La diagnosi, come per l’HFRS si basa sulla identificazione sierologia degli anticorpi IgM e IgG contro il virus Sin nombre in Elisa o WB, sulla dimostrazione dell’agente virale tramite la PCR (su reperti autoptici o bioptici) e sull’immunoistochimica.
Tuttavia è importante per gli operatori sanitari prendere in considerazione la HPS quando un paziente presenta febbre e mialgia se nell’anamnesi rientra un fattore di rischio per l’esposizione al virus o abbiano soggiornato in aree contaminate da escreti di roditori.
Tuttavia anche la mancanza di una tale anamnesi non esclude la HPS. Un rash cutaneo, la rinorrea, la faringite e la congiuntivite sono rare nella HPS e quindi depongono contro la HPS. Tuttavia nel Sud America il rash e la congiuntivite non sono insolite in pazienti con HPS. In caso di sospetto è opportuno eseguire un emocromo completo ed una radiografia del torace.
Non vi è una terapia specifica per l’HPS. Le probabilità di sopravvivenza dall’HPS si basano soprattutto su una diagnosi precoce nella fase prodromica che permetta un pronto invio in unità di terapia intensiva. Chiaramente in attesa di conferme sierologiche viene intrapresa terapia antibiotica a largo spettro.
Le differenze sostanziali tra HFRS e HPS sono essenzialmente:
-
nella HFRS non vi è il gravissimo interessamento polmonare della HPS;
-
nella HPS non si osservano le coagulopatie e le manifestazioni renali presenti invece nella HFRS.
ASPETTI RADIOLOGICI
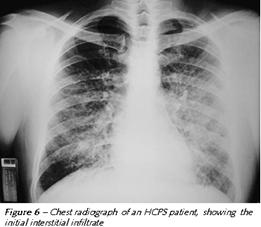
Il riconoscimento delle modificazioni radiologiche causate dalla HCPS è importante nell'identificazione della sindrome e nel determinare la prognosi.
All'inizio il quadro radiologico evidenzia un edema interstiziale:
-
linee B di Kerkey (sottili linee di ispessimento dei setti interlobulari del polmone, localizzate agli angoli costofrenici con andamento orizzontale)
-
ispessimento peribronchiale
-
margini mal definiti dell'immagine ilare polmonare
La HPS ha una caratteristica evoluzione radiologica. All'inizio le radiografie sono molto spesso normali, anche se un terzo dei pazienti mostrano un aumento della trama vascolare o strie B di Kerley. Velocemente poi si formano infiltrati bilaterali (polmone bianco) associato a versamento pelurico.
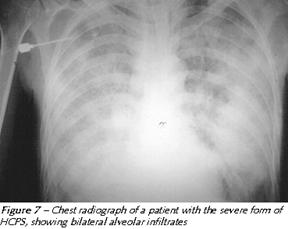
Nella diagnostica differenziale occorre prendere in considerazione varie patologie:
-
polmoniti (come quelle causate dal virus influenzale o da quello del morbillo),
-
polmoniti atipiche (micoplasmi, malattia dei legionari)
-
sepsi con ARDS
-
endocarditi batteriche acute,
-
leptospirosi,
-
febbre Q,
-
dengue emorragica,
-
tularemia,
-
istoplasmosi,
-
coccidioidomicosi,
-
peste setticemica.
Tra le patologie non infettive:
-
infarto miocardio con edema polmonare,
-
sindrome di Goodpasture.
Nei pazienti con alterata funzione immunitaria: polmoniti da
-
Pneumocystis carinii,
-
Citomegalovirus,
-
Criptococco,
-
Aspergillus.
In generale, l’assenza di sintomi nasali nella fase prodromica, quali
-
il naso che cola (rinorrea),
-
starnuti,
-
senso di ostruzione,
depongono per un banale raffreddore piuttosto che la HPS (con l’eccezione delle hantaniosi in Argentina).
Comunque, la maggior attenzione alle infezioni da hantavirus ha portato a considerare come più ampio possa essere lo spettro dell’infezione e più numerosi possano essere i casi di malattia, probabilmente perché lievi o a carattere subclinico, oppure per atipica presentazione della virosi (infezioni da Sin nombre virus senza modifiche respiratorie).
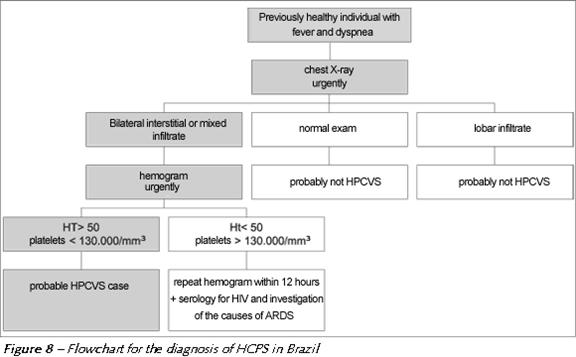
Qui sotto osserviamo una flow-chart utilizzata in Brasile
PREVENZIONE
Le misure preventive si basano soprattutto agendo sulla popolazione murina, con periodici interventi di disinfestazione e derattizzazione. Eliminarli non è praticabile e non desiderabile dal momento che ciò potrebbe indurre uno squilibrio nell’ecosistema, ma controllarne il numero è auspicabile.
Il modo migliore per diminuire il rischio di infezione è limitare i contatti umani con i roditori infetti o il soggiorno in luoghi ristretti dove vi può essere una attiva infestazione da parte di tali animali. In generale si deve sospettare la presenza di un roditore se si scopre:
-
una tana
-
materiale fecale (le feci sono piccole, scure, di forma ovale, simili a chicci di riso)
-
segni di morsicatura sul cibo o altri oggetti
Se la presenza è accertata, occorre allontanarli dagli ambienti domestici, adottando tutte le misure necessarie:
-
verificare gli interstizi e le fessure che hanno un diametro superiore ai 6 mm (i roditori riescono ad introducono negli ambienti di vita e di lavoro attraverso piccoli spazi), chiudendoli col cemento;
-
chiudere le condutture ed i canali di scolo con reti metalliche a maglie fitte;
-
usare contenitori per l’acqua e gli alimenti (anche quelli per gli animali) impermeabili, infrangibili, resistenti al rosicchiamento dei roditori;
-
allontanare in maniera idonea dall’abitazione i rifiuti domestici;
-
conservare i piatti e gli utensili domestici in contenitori non accessibili ai roditori.
In caso di manipolazione di roditori infetti o nella necessità di decontaminare abitazioni infestate da roditori, occorre indossare mezzi di protezione individuale (indumenti protettivi, mascherine, stivali di gomma, occhiali, guanti di gomma).
Per decontaminare ambienti in cui vi sia la possibilità che siano contaminati da escreti infetti di roditori, NON USARE ASPIRAPOLVERE, SCOPE o altri apparecchi che possano disperdere nell’ambiente aerosol contaminati.
Per decontaminare tali ambienti utilizzare soluzioni di ipoclorito di sodio allo 0.5%, fenolo 0.5%, disinfettanti a base di ammonio quaternario oppure la comune varechina in una diluizione di tre cucchiai da tavola in tre litri d’acqua, versati su strofinacci e impregnando con abbondante prodotto le superfici.
Prima di rimuovere i guanti, immergere le mani guantate prima in soluzione disinfettante e poi lavare con acqua e sapone. Rimossi i guanti, lavare le mani con acqua e sapone.
Il Center for Disease Control and Prevention (CDC) statunitense ha creato con parole un facile suggerimento da memorizzare: “seal up, trap up, clean up”, per suggerire norme di comportamento in presenza di roditori come possibile fonte di infezione, che noi traduciamo nella regola delle 3 C:
-
Chiudere
-
Catturare
-
Candeggina
Quindi
Chiudere (seal up), per ricordarsi di sigillare ogni possibile apertura all’interno e all’esterno dell’abitazione per impedire ai roditori di entrare nell’abitazione;


Catturare (trap up), per sollecitare di utilizzare delle trappole al fine di ridurre il numero di roditori; metterle attaccate al muro a formare una T (i roditori preferiscono camminare lungo i muri) e usare del burro di arachidi per attrarli.


Candeggina (clean up), per pulire l’abitazione ed il luogo di lavoro (1 parte di candeggina in 10 parti d’acqua). Far arieggiare la stanza per 30 minuti prima di pulire. Indossare guanti di gomma, lattice o vinile. Spruzzare la soluzione e lasciare per 5 minuti prima di lavare.


In conclusione, preme sottolineare che se la facilità dei viaggi favorisce i trasferimenti in aree geografiche ben diverse dalle nostre e se l’attrattiva paesaggistica può farci gioire della meta raggiunta, non dobbiamo mai dimenticare di informarci prima della partenza sulle norme di comportamento (legate all’ambiente) da tenere in relazione al luogo che visiteremo. L’hantaniosi è una della malattie trasmesse dai roditori, ma essi hanno in serbo altre patologie da trasmettere all’uomo (ad es. leptospirosi, febbre da morso di gatto - sodoku in giapponese -, coriomeningite linfocitaria LMCV).
“Non lo sapevo” non è più una scusa valida in un’epoca in cui l’informazione è globale. Viaggiare permette di arricchire il nostro vissuto confrontandoci con altre realtà, spesso piacevolissime ma qualche volta ahimè fonte di preoccupazione.


